Las proteínas -Tema 5-
El post de hoy trata sobre las proteínas, sus características, sus propiedades y sus funciones. Como en cada tema, he realizado un esquema que recoge toda la información sobre las proteínas. Por último, he realizado unos ejercicios sobre este último tema explicado en clase que sirven para repasar los nuevos contenidos.
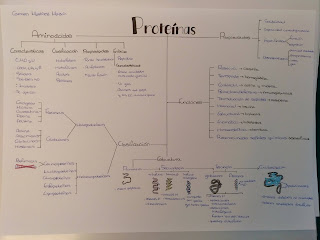
Para comenzar, aquí dejo el esquema de las proteínas. En el se pueden ver las propiedades, características y clasificación, entre otros, de los aminoácidos, subunidad que forma las proteínas, y el tipo de enlace que se produce en la unión de dos o más aminoácidos, llamado enlace peptídico. En cuanto a las proteínas, se puede observar la diferenciación entre las holoproteínas y las heteroproteínas y sus diferentes estructuras, desde la estructura más sencilla a la más compleja. También se pueden observar las funciones que realizan y las diferentes propiedades que tienen, como su capacidad amortiguadora y su especificidad.
 |
| Imagen propia |
 |
| Fuente: Wikipedia |
 |
| Estructura secundaria: hélice de colágeno Fuente: Dreamstime |
A continuación, los ejercicios realizados:
ACTIVIDADES DE PROTEÍNAS
1. Con respecto a las proteínas:
a) Enumerar los cuatro niveles de estructura de las proteínas.
Las proteínas tienen cuatro estructuras: estructura primaria, estructura secundaria, estructura terciaria y estructura cuaternaria. En el caso de la estructura secundaria podemos encontrar la α-hélice, la conformación β y la hélice de colágeno. En el caso de la estructura terciaria se distinguen las proteínas globulares y las fibrosas o filamentosas.
b) Indicar qué tipos de enlaces intervienen en la estabilización de cada uno de estos niveles estructurales.
En la estructura primaria se establecen enlaces peptídicos entre los diferentes aminoácidos y enlaces covalentes entre los radicales del propio aminoácido. En la estructura secundaria se establecen los mismo enlace que en la anterior estructura pero en la α-hélice se establecen enlaces de puentes de hidrógeno intracatenarios y en la conformación β estos enlaces son intercatenarios. Además, la hélice de colágeno está compuesta por tres hélices unidas por enlaces covalentes y por enlaces débiles de tipo puente de hidrógeno. En la estructura terciaria se encuentran enlaces de hidrógenos entre grupos peptídicos, atracciones electrostáticas entre grupos con carga opuesta, atracciones hidrofóbicas, enlaces de Van der Waals y enlaces de tipo disulfuro entre grupos tiol (-SH). Por último, la estructura cuaternaria se encuentra unida por enlaces débiles, no covalentes, y en algunas ocasiones por enlaces covalentes de tipo disulfuro.
c) Especificar la estructura que caracteriza a las α-queratinas.
Las α-queratinas son unas proteínas con forma de α-hélice, perteneciente a la estructura secundaria.
d) Describir dos propiedades generales de las proteínas.
- Solubilidad: la localización de los radicales polares en la superficie externa de las proteínas hacen que se establezcan enlaces de hidrógeno con el agua, provocando que las proteínas queden rodeadas de agua y que no se puedan unir a otras. Las proteínas fibrosas son insolubles.
- Especificidad: las proteínas pueden ser especificas de función según la posición de algunos aminoácidos de la secuencia lineal y pueden ser específicas de especie, es decir, que las proteínas homologas en distintas especies tienen la misma función pero una composición y estructura algo diferentes.
e) Describir dos funciones de las proteínas. Indica ejemplo.
- Función contráctil: hay proteínas que permiten el movimiento, como la flagelina en los flagelos bacterianos, y otras que intervienen en la contracción muscular, como es el caso de la actina y la miosina.
- Función de reserva: almacenan aminoácidos para poder utilizarlos posteriormente como nutrientes o para la formación del embrión. Algunos ejemplos son la ovoalbúmina y la caseína.
f) Defina el proceso de desnaturalización. ¿Qué tipo de enlaces no se ven afectados?
La desnaturalización es el proceso por el que se rompen los enlaces de la proteína, dejándola en forma de secuencia lineal sin romper los enlaces peptídicos. Este proceso se puede realizar mediante el aumento de temperatura, por la polaridad del disolvente, por la urea o por el pH. Las proteínas que han sido desnaturalizadas dejan de realizar su actividad biológica. La desnaturalización puede ser reversible, renaturalización, siempre que no se hayan roto los enlaces peptídicos.
La desnaturalización es el proceso por el que se rompen los enlaces de la proteína, dejándola en forma de secuencia lineal sin romper los enlaces peptídicos. Este proceso se puede realizar mediante el aumento de temperatura, por la polaridad del disolvente, por la urea o por el pH. Las proteínas que han sido desnaturalizadas dejan de realizar su actividad biológica. La desnaturalización puede ser reversible, renaturalización, siempre que no se hayan roto los enlaces peptídicos.
g) ¿Qué significa que un aminoácido es anfótero?
Que un aminoácido sea anfótero significa que tiene capacidad de regular el medio en el que se encuentra captando portones o soltándolos al medio. Se podría decir que actúan como disoluciones tampón o amortiguadoras.
Que un aminoácido sea anfótero significa que tiene capacidad de regular el medio en el que se encuentra captando portones o soltándolos al medio. Se podría decir que actúan como disoluciones tampón o amortiguadoras.
REPASO PREGUNTAS PAU DE PROTEÍNAS
1. En la siguiente reacción dos monómeros reaccionan para formar un dímero:
 |
| Imagen del documento de las actividades |
a) ¿Qué moléculas son estos monómeros? ¿En qué tipo de macromoléculas se encuentra esta unión?
Estos monómeros son aminoácidos que se unen mediante un enlace peptídico. Este tipo de enlace es propio de las proteínas.
b) ¿Cómo se denomina el enlace entre estos monómeros? ¿Cuáles son las características de este enlace?
Este enlace es de tipo peptídico. Estos enlaces son más cortos que los enlaces C-N. Se trata de una unión que posee cierto carácter de doble enlace y por esto no puede girar, a excepción de los enlaces C-C y N-C que pueden girar pero no con total libertad. Los átomos del enlace peptídico y los dos átomos de carbono a los que están unidos se encuentran en un mismo plano.
c) Cita dos ejemplos de esta macromolécula e indica su función.
Hemoglobina : tiene función de transporte, ya que transporta el oxígeno desde el aparato respiratorio hasta las células de todo el organismo.Además, es un pigmento de color rojo presente en la sangre de vertebrados.
Insulina : es una proteína con función hormonal que es secretada por el páncreas cuando las concentraciones de glucosa en sangre son elevadas. Retira la glucosa del torrente sanguíneo y la transporta a las células , donde se metaboliza mediante glucolísis.
2. Explica el tipo de interacciones o enlaces que estabilizan la estructura secundaria y terciaria en proteínas.
En la estructura secundaria se establecen enlaces peptídicos y enlaces covalentes procedentes de la estructura primaria y los enlaces propios de cada una de sus tres formaciones. En la α-hélice se establecen enlaces de puentes de hidrógeno intracatenarios y en la conformación β estos enlaces son intercatenarios. Además, la hélice de colágeno está compuesta por tres hélices unidas por enlaces covalentes y por enlaces débiles de tipo puente de hidrógeno. En la estructura terciaria se encuentran enlaces de hidrógenos entre grupos peptídicos, atracciones electrostáticas entre grupos con carga opuesta, atracciones hidrofóbicas, enlaces de Van der Waals y enlaces de tipo disulfuro entre grupos tiol (-SH).
3. ¿Qué significa que los aminoácidos son anfóteros? ¿A qué se debe esta característica?
Que los aminoácidos sean anfóteros significa que tienen capacidad de ganar o perder electrones en función del medio. Esta característica se debe al punto isoeléctrico de los aminoácidos, que se produce cuando el aminoácido tiene ionizado negativamente el radical -COOH y el radical -NH₂ se encuentra ionizado positivamente.
4. En relación a la estructura de proteínas:
a) Explica qué es la estructura terciaria y qué tipo de fuerzas o interacciones participan en el mantenimiento de la estructura terciaria. ¿Existe un nivel estructural superior a la estructura terciaria? En caso afirmativo, indica en qué ocasiones se forma.
La estructura terciaria es la disposición que adopta la estructura secundaria tras haberse plegado sobre sí misma y da como resultado una conformación globular. En la estructura terciaria se encuentran enlaces de hidrógenos entre grupos peptídicos, atracciones electrostáticas entre grupos con carga opuesta, atracciones hidrofóbicas, enlaces de Van der Waals y enlaces de tipo disulfuro entre grupos -SH, también llamados grupos tiol. Sí que existe un nivel estructural superior que es la estructura cuaternaria. Se forma tras la unión de cadenas polipeptídicas con estructura terciaria, llamadas protómero.
b) Al medir la actividad de la enzima hexoquinasa se produjo, accidentalmente un aumento de la temperatura hasta los 80ºC. En esas condiciones no se detectó actividad de la enzima. Explica qué proceso justifica esta observación.
No se observa actividad enzimática porque la enzima, al haber aumentado la temperatura, ha sufrido un fenómeno llamado desnaturalización que ha roto los enlaces de la enzima, menos los enlaces peptídicos, e impide que realice su actividad biológica.


Comentarios
Publicar un comentario